TIRA - DÚVIDAS
A atividade TIRA - DÚVIDAS, muito apreciada e elogiada pelos alunos de anos anteriores, consiste em receber nas secretarias dos cursos, por escrito ou através do endereço eletrônico , questões ou tópicos que o aluno não está conseguindo resolver/entender e socializar as resoluções impressas com todos os demais alunos dos cursos. A dúvida de um geralmente é a dúvida de muitos.
Algumas
dúvidas anteriores:
SABRINA
THAIS DOS SANTOS SILVA – TURMA TARDE - ALUNA 2008 – HANNS WEBER EM ISOLADAS
REUNIDAS – GRANDES MESTRES – 0102 - COVEST – PE – 1ª FASE – 98 - O
isótopo de massa 14 do Carbono sofre decaimento
segundo a reação abaixo. Acerca de sua meia-vida é correto afirmar que:
a-)
Aumenta com o aumento da pressão.
b-)
Não varia com o aumento da temperatura.
c-)
Diminui com o abaixamento da pressão.
d-)
Aumenta com a concentração de 14C6
e-)
Aumenta com a concentração de 14N7
R: Letra: B
As reações nucleares não sofrem
interferência das condições externas (pressão, temperatura), nem mesmo o tempo
de meia-vida sofre modificação com as concentrações das espécies
SABRINA
THAIS DOS SANTOS SILVA – TURMA TARDE - ALUNA 2008 – HANNS WEBER EM ISOLADAS
REUNIDAS – GRANDES MESTRES – 0114 - FESP- UPE – 1985 – Um
estudante dispõe de um sólido e, deseja determinar experimentalmente sua densidade
aproximada. Qual dos procedimentos abaixo o ajudará a concluir seu objetivo?
a)
dissolver o sólido e depois aquecê–lo em banho-maria, determinando em seguida
sua temperatura
b)
pipetar um volume conhecido de água destilada, colocá–lo em um tubo de ensaio e
em seguida imergir o sólido
c)
Pesar o sólido, colocá–lo numa proveta contendo um volume conhecido de água destilada,
e em seguida determinar a variação de volume ocorrida, após a introdução do sólido
na proveta
d)
Pesar o sólido, colocá–lo numa bureta, e em seguida dividir a massa sólido pelo
volume indicado na bureta.
e)
pesar o sólido, colocá–lo numa pipeta após sua pulverização e, em seguida
achar-se o quociente entre a massa pulverizada e o volume indicado da pipeta.
R: Letra: C
Ele quer determinara a densidade,
logo a razão entre a massa e o volume. Só a letra C contempla essa situação
pois a massa é pesada e volume determinado pelo Princípio de Arquimedes, aquele
da banheira quesaiu correndo gritando EUREKA! EUREKA!, o voolume que saia da
banheira era igual ao volume de seu corpo.
SABRINA
THAIS DOS SANTOS SILVA WEBER EM ISOLADAS REUNIDAS FASE – 94 – 15 – Uma
amostra mineral forneceu para a idade da Terra o valor de 4,0 bilhões de anos.
O elemento radioativo presente nesta amostra tem um tempo de meia vida de 800
milhões de anos e a fração do elemento ainda em atividade é 2n quantidade
original. Qual o valor de n? (fórmula ln (Co/c)=Kt, onde ln significa o logaritmo
natural.)
R: 05
t= 4,0bilhões de anos
P= 800milhõe de anos
t= n x P
4 x 109 = n x 8 x 108
SABRINA
THAIS DOS SANTOS SILVA WEBER EM ISOLADAS REUNIDAS 2000 - Em
um tubo de ensaio, uma pequena mecha de palha de aço foi suavemente comprimida.
Em seguida, inverteu mostra a figura
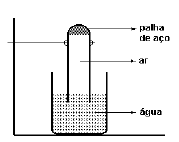
Após
alguns dias, deve-se afirmar que a massa do material sólido no interior do tubo
a)
diminui, e o nível da água dentro do tubo de ensaio subiu.
b)
diminui, e o nível da água dentro do tubo de ensaio baixou.
c)
aumentou, e o nível da água dentro do tubo de ensaio baixou.
d)
aumentou, e o nível da água dentro do tubo de ensaio subiu.
e)
aumentou, e o nível da água dentro do tubo de ensaio permaneceu o mesmo.
R: Letra: D
A massa aumentou pois houve
reação entre o ferro com o oxigênio, formando óxido de ferrro, como a
quantidade d eoxigênio dentro do tubo diminuiu pela reação a pressão de vapor
deste diminiui e a pressão de vapor da água contiuando a mesma, logo se torna
maior que a pressão de oxigênio. O aumento do volume provoca a redução da
pressão de vapor da água tornando-a de novo igual a do oxigênio
ANDREZA TIFA - ALUNA 2008 –
ISOLADAS REUNIDAS – GRANDES MESTRES
Na hora fiquei pensando sobre o fato ficou uma
dúvida na hora: pq a água consegue apagar o fogo, e o q acontece exatamente
para poder ocorrer ?
Logo que entra em contato com o objeto em chamas, a
água se transforma em vapor e, assim, priva-o de parte de seu calor.
Para se transformar água fervente em vapor,
precisamos de pouco mais de cinco vezes o calor que é exigido para aquecer
a mesma quantidade de água fria até o ponto de ebulição.
Por lado, o vapor produzido assim ocupa um
espaço centenas de vezes maior em volume do que a água que o produziu.
O vapor envolve o objeto aceso e impede a renovação
do ar.
Sem o ar (oxigênio) a combustão é impossível.
THAYSE ALBUQUERQUE DA SILVA, - ALUNA 2008 – ISOLADAS
REUNIDAS – GRANDES MESTRES
OI PROFESSOR! me explique o que é flogisto e comburente?
A teoria do flogisto
(ou do flogístico) teve sua origem , com um químico alemão chamado
GEORG ERNAST STHAL. Dizia a teoria que os corpos combustíveis possuem uma
matéria chamada flogisto que era liberada ao ar durante a queima. Flogisto vem
do grego e significa inflamável.
Stahl também afirmava
que, pelo fato da oxidação dos metais ser um processo análogo à combustão,
também devia envolver perda de flogisto.
Segundo a teoria, os
metais deveriam perder flogisto quando fossem expostos ao aquecimento, mas de
acordo com os próprios defensores da teoria, esses ganhavam peso, o que levou
Lavoisier a refletir sobre o que haveria acontecido com o elusivo flogisto.
Lavoisier levou
muitos anos tentando derrubar definitivamente essa teoria, mas somente com a
descoberta acidental do oxigênio (batizado por Priestley de ar
desflogisticado) feita por JOSEPH PRESLEY no dia 01 de agosto de 1774
é que se teve base para enfrentar a teoria do flogisto.
Através de intensas
investigações repetindo os experimentos de Priesley entre os anos de 1775 a
1780, Lavoisier estava convencido de que o ar de Priesley era o princípio ativo
da atmosfera. Realizando vários experimentos brilhantes, Lavoisier mostrou que
o ar contém 20 por cento de oxigênio e que a combustão é devida a combinação de
uma substância combustível com o oxigênio. Ficou provado também o seu papel na
respiração.
COMBURENTE - É o material gasoso que pode reagir com um
combustível, produzindo a combustão.Toda substância que alimenta a combustão.
01 - TIRA – DÚVIDAS – 2004 – ITAMAR ALVES DA SILVA - LIVRO RICARDO FELTRE - Numa mistura de gases , a relação entre as massas de Oxigênio e Neônio é 0,40 . Consequentemente , a relação entre seus números de moles é : ( O=16 , Ne=20 )
a) 0,16 b) 0,20 c) 0,25 d) 0,40 e) 4,00
R : Letra: C
m Oxig / m Neônioo = 0,40 Como n= m / M onde n = números de mols e m= massa e M = Peso molecular, teremos:
n Oxig x M Oxig n Oxig x 32 n Oxig x 32 n Oxig 0,40 x 20
![]()
![]()
![]()
![]()
![]() =
0,40
= 0,40 =
0,40 x
20
=
= 0,25
=
0,40
= 0,40 =
0,40 x
20
=
= 0,25
n Hélio x M Neônio n Neônio x 20 n Neônio n Neônio 32
02 – TIRA – DÚVIDAS – 2004 – ITAMAR ALVES DA SILVA - LIVRO RICARDO FELTRE - Dissolvendo-se 1 mol de sulfato de alumínio e 1 mol de fosfato diácido de sódio em água ( considerar o grau de dissociação igual a 1 para as duas substâncias ) , o número de cátions presentes na solução será igual a:
a) 6,0 x 10 22 b) 3,0 x 1024 c) 2,4 x 1024 d) 1,8 x 1024 e) 1,8 x 1023
R : Letra: D
1 mol de sulfato de alumínio Al2 ( SO4 ) 3 è 2 Al + + + + 3 SO4 - - 100 % dissociado
1 mol de fosfato ácido de sódio NaH2PO4 è Na + + H2PO4 – 100% dissociado
Cátions : 2 Al +++ = 2 mols 1 Na += 1 mol Total : 3 mols = 3 x 6,02 x 10 23 = 18,06 x 10 23 = 1,8 x 10 24
03 – TIRA – DÚVIDAS – 2004 – ITAMAR ALVES DA SILVA LIVRO RICARDO FELTRE - Ao se dissolverem 5 moléculas-grama de um ácido HX, em quantidade suficiente de água, constatou-se que 4 moléculas-grama do soluto se ionizaram.Pede-se :
a) O grau de ionização de HX
b) O número de íons existentes na solução obtida.
R :
a) HX è H + + X –
5 moléc-gramas 4 moléc-gramas 4 moléc- grmas
Logo se dissociassem as 5 teríamos 100%: 5 moléc-grmas è 100%
4 moléc-gramas è x % x= 80%
b) HX è H + + X –
5 mols 4 mols 4 mols
Portanto, terremos cátions : 4 mols
Anions: 4 mols
Total : 8 mols de íons
04 - TIRA – DÚVIDAS – 2004 – BRUNA GOMES FREIRE – NOVOS RUMOS 2004 – 15 – ITA – 2004 - O 82Pb 214 desintegra-se por emissão de partículas Beta, transformando-se em 83Bi214 que, por sua vez, se desintegra também por emissão de partículas Beta, transformando-se em 84Po.214
A figura abaixo mostra como varia, com o tempo, o número de átomos, em porcentagem de partículas, envolvidos nestes processos de desintegração. Admita ln 2 = 0,69. Considere que, para estes processos, sejam feitas as seguintes afirmações:
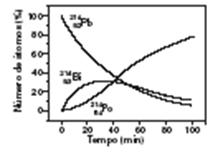
I. O tempo de meia-vida do chumbo é de aproximadamente 27 min.
II. A constante de velocidade da desintegração do chumbo é de aproximadamente 3 x 10– 2 min–1.
III. A velocidade de formação de polônio é igual à velocidade de desintegração do bismuto.
IV. O tempo de meia-vida do bismuto é maior que o do chumbo.
V. A constante de velocidade de decaimento do bismuto é de aproximadamente 1 x 10–2 min–1.
Das afirmações acima, estão corretas
a) apenas I, II e III b) apenas I e IV c) apenas II, III e V
d) apenas III e IV e) apenas IV e V.
R:Letra: A
A afirmação I é correta pois, pelo gráfico, verificamos que a meia-vida do 214Pb é aproximadamente 27 minutos.
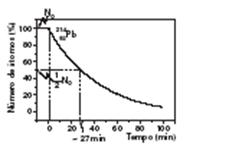
A afirmação II é correta , pois


A afirmação III é haja visto a equação:
![]()
De acordo com o decaimento radioativo, para cada átomo de 84 Po 214, formado, há o decaimento de 1 átomo de 83 Bi 214. Logo, as velocidades de formação do polônio e desintegração do bismuto são iguais.
Afirmação IV: É incorreta, pois de acordo com o gráfico, quando são decorridos 70 minutos, teremos, aproximadamente, 60% de átomos de 84 Po 214 e 20% de átomos de 83 Bi 214. Como as velocidades de desintegração do bismuto e de formação de polônio são iguais, ao aumentar para 70% o percentul de átomos de poônio, o percentual de átomos de bismuto terá partido de 20% para 10% em função apenas da desintegração. Portanto esse é o tempo de meia-vida do bismuto.
Assim, teremos a seguinte situação gráfica:
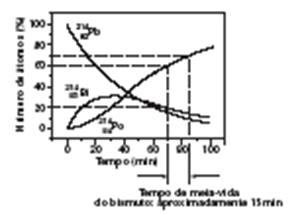
Logo, 0 t ½ bismuto é inferior ao t1/2 do chumbo
Afirmação V é falsa pois

05 – ITAMAR ALVES DA
SILVA – 2004 - TURMA F - 1,7 toneladas de amônia vazaram e se
espalharam uniformemente em certo
volume da atmosfera terrestre, a 27O C e 760 mmHg. Medidas mostraram que a
concentração de amônia neste volume da atmosfera era
de 25 partes, em volume, do gás amônia, em um milhão de partes, em volume, de
ar. Qual o volume da atmosfera contaminada por esta quantidade de amônia?
Resposta: 9,84.107 m3
1,7 ton NH3 è 1,7 x 10 6 g de NH3 T = 27 + 273 = 300 K P = 760 mmHg = 1 atm
P.V = m / m . R . T P = 1,7 X 10 6 . 0,082 . 300 / 17 = 2,46 X 106 L
103 L è 1 m 3
106 L è X X = 103 m3
25 partes de NH3 è 10 6 de Ar
2,46 x 10 6 m3 è Y Y = 9,84 x 103 m3
TIRA – DÚVIDAS Nº 01 - 2003
01 - – MARINA LINS MAYMONE DE MELO – NOVOS RUMOS NOITE – 2003 – Você está cozinhando batatase fazendo carne grelhada, tudo em fogo baixo, num fogão a gás. Se você passar as duas bocas do fogão para fogo alto, o que acontecerá com o tempo de preparo?
Diminuirá para a carne devido ao aumento da quantidade e calor fornecido. Já no caso das batatas, como já está em fervura e como a água ferve à temperatura constante de 100ºC ao nível do mar, o aumento ou diminuição do calor fornecido não alterará a temperatura de cozimento e conseqüentemente o tempo de preparo será o mesmo
02- – MARINA LINS MAYMONE DE MELO – NOVOS RUMOS NOITE – 2003 – Um isótopo radioativo do iodo com período de meia vida de 8,1 dias, foi utilizado em um teste para se determinar a absorção de íons iodeto por plantas aquáticas. As plantas foram colocadas em um aquário com água contendo esse isótopo na forma de íons iodeto. A atividade radioativa inicial de uma amostra de 1,00 mL de água foi de 80 c.p.m ( contagens por minuto ) . Após 16,2 dias a atividade de uma amostra de mesmo volume foi medida obtendo-se o valor de 11 c.p.m.. Assumindo-se que os únicos processos responsáveis pela queda na atividade sejam a absorção de iodeto pelas plantas e o decaimento radioativo, qual a percentagem de iodo pelas plantas nesse período?
Amostra inicial = amostra que sofre quantidade absorvida amostra restante
decaimento radioativo + pelas plantas + ( 11 c.p.m. )
Decaimento radioativo: TTotal = x . t ½ 16,2 = x . 8,1 è x = 2
80 c.p.m. 1 40 c.p.m 2 20 c.p.m ou 2 x = m0 / mf 2 2 = 80 / mf mf = 20 c.p.m.
Essa é a quantidade que sobrou após o decaimento. Se a amostra restante foi igual a 11 c.p.m. , então a planta absorveu 9 c.p.m ( 20 – 11 = 9 c.p.m. ) . Por regra de três teremos:
20 c.p.m. è 100 %
9 c.p.m. è y % y = 45%
03 - PAULO ROBERTO S. DA COSTA CIRNE – MASTER - MANHÃ – 2003 – PUC – RJ – Considere as seguintes informações sobre átomos A, B e C.:
a - A e B são isótopos
b – A e C são isótonos
c – B e C são isóbaros
d – O número de massa de A é igual a 55
e – A soma dos números de prótons de A , B e C é igual a 79
f – A soma dos números de nêutrons de a, B e C é igual a 88
Determine os números atômicos e de massa de A , B e C.
Resolução :
p A 55 p B A = p + y x C A = n + x
n y n
Poderemos obter as seguintes equações matemáticas:
1) p + p + x = 79 2p + x = 79 x = 79 – 2p
2) n + y + n =88 2n + y = 88 y = 88 – 2n
3) p + n = 55 n = 55 – p
4) p + y = n + x
Substituindo 1, 2 e 3 na equação 4, obteremos:
5) p + ( 88 – 2n ) = ( 55 – p ) + ( 79 – 2p )
Para obtermos uma equação somente em função de p, substituímos novamente 3 em 5:
p + 88 – 2 ( 55 – p ) = 55 – p + 79 – 2p
p + 88 – 110 + 2p = 55 – p + 79 – 2p
p + 2p + p + 2p = - 88 + 110 + 55 +79
6p = 156 p = 26
Substituindo p = 26 em 3 temos:
26 + n = 55 n = 55 – 26 = 29 n = 29
Substituindo n= 29 em 2 teremos:
y = 88 – 2 . 29 y = 30
Substituindo p = 26 em 1 teremos:
x = 79 – 2 . 26 x = 27
Logo os átomos serão assim caracterizados :
A : z = 26 e A = 55 e n = 29
B : z = 26 e A = 56 e n = 30
C : z = 27 e A = 29 e n = 56
01 - FESP-UPE- Pode-se obter HCl através da reação :
2 NaCl + H2SO4 è Na2SO4 + 2 HCl
que será absorvido em 2 L de água destilada. A massa de NaCl necessária para obtermos uma solução a 30 % em peso de HCl será:
a-) 1373,78 g
b-) 952,35 g
c-) 686,89 g
d-) 343,45 g
e-) 425,45 g
RICARDO FELTRE – VOLUME 2 – ED. MODERNA – SP – EBERTH ALMEIDA RODRIGUES – ALUNO Q3 – 2000 – TURMA A2
R: Letra: A
Equação química: 2 NaCl + H2SO4 è Na2SO4 + 2 HCl
Dados: 2 L de H2O
30% em peso de HCl
m NaCl ?
Comentário:
Através da equação mencionada acima podemos concluir que é devidamente possível obtermos ácido clorídrico a partir de cloreto de sódio, com a seguinte proporção estequiométrica:
Reagentes Produtos
2 NaCl è 2 HCl
Resolução:
2 L de H2O è 2.000 g de H2O massa de solvente è 70%
x g de HCl massa de soluto è 30%
2.000 g è 70 %
x è 30% x = 857,14 g de HCl
Pela equação: 2 NaCl è 2 HCl
2 x 58,5 g de NaCl è 2 x 36,5 de HCl
y g de NaCl è 857,14 g de HCl y = 1.373,77 g de NaCl
02 - FESP-UPE – Dispõe – se de 20 litros de água oxigenada a 125 volumes. Para se preparar 100,0 litros de água oxigenada a 10 volumes, deve-se proceder praticamente da seguinte forma:
a- ) toma-se 10 litros de água oxigenada a 125 volumes e dilui-se a 100 litros
b- ) toma-se 100 litros de água oxigenada a 125 volumes e aquece-se até a proporção desejada
c- ) toma-se 8 litros de água oxigenada a 125 volumes e dilui-se a 100 litros
d- ) toma-se 80,0 litros de água oxigenada a 125 volumes e dilui-se a 100 litros
e- ) toma-se 125 litros de água oxigenada a 125 volumes e dilui-se a 100 litros
Dado: 1 litro de água oxigenada a 125 volumes libera 125 litros de oxigênio ( O2 ) nas CNTP
VERA NOVAIS – FÍSICO QUÍMICA – ATUAL EDITORA – SP – FRANCISCO BRUNO FERREIRA GUSMÃO - – ALUNO Q3 – 2000 – TURMA A2
R: Letra: C
Comentário:
Inicialmente temos 20 litros de H2O2 a 125 volumes, com esses dados é possível calcular a concentração de O2 que dispomos:
1 litro de H2O2 è 125 volumes è 125 litros de O2 ( g )
20 litros de H2O2 è 125 volumes è x litros de O2
x = 2 500 litros de O2
Observe que 125 volumes è 125 litros de O2
1 volume è z z = 1 litro de O2
O propósito desta questão foi alterado, observe:
Preparar 100 litros de água oxigenada a 10 volumes:
1 litro de H2O2 è 10 volumes è 10 litros
100 litros de H2O2 è 10 volumes è y y = 1 000 litros de O2
Devemos encontrar como alternativa correta, aquela alternativa que libera 1000 litros de O2
1 litro de H2O2 è 125 volumes è 125 litros O2
8 litros de H2O2 è 125 volumes è w w = 1000 litros de O2
03 - PUC- MG – Um grave problema ambiental da atualidade é o aquecimento das águas de rios, lagos e mares por indústrias que as utilizam para o resfriamento de turbinas e elevam sua temperatura até 25º acima do normal. Isso pode provocar a morte de peixes e outras espécies aquáticas,ao diminuir a quantidade de oxigênio dissolvido na água. Portanto, é correto concluir que:
a- ) Esse aquecimento diminui a solubilidade do oxigênio dissolvido na água, provocando o seu desprendimento
b- ) Esse aquecimento provoca o rompimento das ligações H e O nas moléculas de água
c- ) Esse aquecimento provoca o aparecimento de gás carbônico
d- ) Esse aquecimento faz com que mais um átomo de oxigênio se ligue a cada molécula de água, produzindo água oxigenada
e- ) Os peixes e outras espécies acabam morrendo por aquecimento e não por asfixia.
VERA NOVAIS – FÍSICO QUÍMICA – ATUAL EDITORA – SP – FRANCISCO BRUNO FERREIRA GUSMÃO - – ALUNO Q3 – 2000 – TURMA A2
R: Letra: A
Podemos considerar a água dos rios, lagos e mares, como sendo uma solução ( H2O + O2 ). O aquecimento diminui a solubilidade do oxigênio dissolvido na água, provocando o seu desprendimento
04 - A solubilidade do ar no sangue, a 1 atm e à temperatura de 37ºC, é de 6,6 x 10-4 mol/L. Suponha um mergulhador que respire ar comprimido a 10 atm. Suponha também que o volume de sangue circulante seja de 7 litros.
a-) Calcule o volume de ar total que sairá do organismo quando o indivíduo voltar à superfície, onde a pressão é de 1 atm?
b-) Qual o risco que o mergulhador corre se essa descompressão não se der num tempo adequado?
Volume molar ( 37º C , 1 atm ) = 25,4 L / mol.
VERA NOVAIS – FÍSICO QUÍMICA – ATUAL EDITORA – SP – FRANCISCO BRUNO FERREIRA GUSMÃO - – ALUNO Q3 – 2000 – TURMA A2
R: a-) Pouco
mais de 1 litro de ar ( 1, 056 L )sairá do organismo na forma de bolhas
b-) Uma subida rápida e descontrolada poderá causar uma embolia (obstrução dos vasos sangüíneos), devido à grande quantidade de bolhas de ar que deixam o organismo.
05 - ITA – SP – 1,7 toneladas de amônia vazou e se espalhou uniformemente em certo volume da atmosfera terrestre, a 27º C e 760 mm Hg. Medidas mostraram que a concentração de amônia neste volume da atmosfera era de 25 partes, em volume, de gás amônia, em um milhão de partes em volume, de ar. O volume da atmosfera contaminado por esta quantidade de amônia foi;
a- ) 0,9 . 10 2 m3
b- ) 1 . 10 2 m3
c- ) 9 . 10 7 m3
d- ) 10 . 10 7 m3
e- ) 25 . 10 8 m3
VERA NOVAIS – FÍSICO QUÍMICA – ATUAL EDITORA – SP – FRANCISCO BRUNO FERREIRA GUSMÃO - – ALUNO Q3 – 2000 – TURMA A2
R: Letra: D
1,7 ton de amônia = 1.700 kg de amônia = 1.700.000 g de amônia
Cálculo da quantidade de amônia:
1 mol de amônia ( NH3 ) è 17 g de amônia
x g de ammonia è 1.700.000 g de ammonia x= 10 5 mols de NH3
Cálculo do volume de amônia:
1 mol de NH3 (g ) è 22,4 L
10 5 mols NH3 (g ) è y L y = 22,4 x 10 5 L NH3
Obs: A 27ºC e 760 mmHg o volume molar é aproximadamente 22,4 L
Cálculo do volume total de ar:
25 partes è Volume de amônia
106 partes è Volume total de ar
25 partes è 22,4 . 10 5 Litros
10 6 partes è z L z = 1. 10 11litros de ar
OBS: 1 Litro = 1 dm 3 = 10 –3 m3
Z = 1. 10 11 . 10 –3 m3 è z = 1. 108 m3 è z = 10 . 10 7 m3
06 - E.E. MAUÁ –SP – A massa de 4,38 g de um certo metal ( Me ) reage completamente com 0,56 L de oxigênio nas CNTP, produzindo 5,18 g do óxido metálico. Massa atômica do Oxigênio = 16 e volume molar =22,4 L
a- Calcule o equivalente – grama do metal
b- Sobrou oxigênio após a reação ?
RICARDO FELTRE – VOLUME 2 – ED. MODERNA – SP – EBERTH ALMEIDA RODRIGUES – ALUNO Q3 – 2000 – TURMA A2
R:
Resolução:
Me + oxigênio è óxido metálico
4,38 g x 5,18 g
4,38 g + x = 5,18 g x = 0,8 g de oxigênio
a) 1 equivalente do metal 1 equivalente do oxigênio
Me 8g
4,38 g 0,8 g Me = 43,8 g
1 equivalente grama do metal = 43,8 g
b) 1 mol de oxigênio ( O2 ) 22,4 L 32 g de oxigênio
0,56 L y
y = 0,8 g de oxigênio
Conclusão: Não sobrou oxigênio, toda massa colocada nos reagentes foi consumida na reação.
07 – FESP – UPE – Duas soluções de NaOH e Ca(OH)2 têm a mesma concentração porcentual de 15 % . Quantos litros de cada uma devem ser misturados para se obter 3 L de solução básica 3,97 N ?
a- ) 0,8 L de NaOH e 2,2 L de Ca(OH)2
b- ) 2,2 L de Ca( OH )2 e 0,8 L de NaOH
c- ) 0,5 L de NaOH e 1,5 L de Ca(OH)2
d- ) 1,0 L de NaOH e 2,0 L de Ca(OH)2
e- ) 1,5 L de NaOH e 0,5 L de Ca(OH)2
R: Letra:
NaOH è Solução 15 % Ca(OH)2 è Solução 15%
Dsoluções = 1 g / mL
1 g è 1 mL
x g è 1000 mL x = 1000 g = 1000 mL
150 g de NaOH è 3,75 mols de NaOH
150 g de Ca(OH)2 è 2 mols de Ca(OH)2
Transformação de Molaridade para Normalidade: N = x M
Para NaOH N = 1 x 3,75 N = 3,75
Para Ca(OH)2 N = 2 x 2 N = 4
Temos
N1 x V1 + N2 x V2 = Nf x Vf 3,75 x V1 + 4 V2 = 3,97 Vf Mas V1 + V2 = 3 L
3,75 x V1 + 4 ( 3 – V1 ) = 3, 97 x 3 3,75 V1 + 12 - 4 V1 = 11,91 - 0,25 V1 = - 0,09
V1 0,36 L de NaOH e V2 = 2,64 L de Ca(OH)2
RICARDO FELTRE – VOL 2 – SOLUÇÕES – Tira - Dúvidas - Aluna: EVELINE VALERIANO MOURA – Q 3 – 2000 – TURMA A1
08 – VUNESP - A “água de lavadeira “é uma solução aquosa diluída de NaClO. Quando essa solução é tratada com excesso de íons I – em meio ácido, os íons ClO – são reduzidos a Cl -- . e os íons I – são inicialmente oxidados a I2. O I2 formado reage imediatamente com excesso de I – presente, formando I3 - . Nessas condições a equação global da reação é:
ClO - + 3 I - + 2 H + è Cl- + I3 - + H2O
São necessários 40,0 mL de solução aquosa de KI de concentração 250 mol / L, para reagir completamente com 50,0 g de água de lavadeira, segundo a equação acima. Calcule a porcentagem em massa de NaClO na “água de lavadeira”.
Cl O –1 + I –1 + H + è Cl-1 + I3 –1 + H2O
a) Equação balanceada:
1 Cl O –1 + 3 I –1 + 2 H + è 1 Cl-1 + 1 I3 –1 + 1 H2O
b) Observe que as estruturas 1 ClO-1 + 3 I-1foram provenientes do 1 NaClO ( hipoclorito de sódio ) e do 3 KI ( iodeto de potássio)
Podemos afirma: 1 NaClO è 3 KI
Análise do KI
2,5 mol è 1 L
x è 0,04 L x = 0,1 mol KI
1 mol NaClO è 3 mols KI
y è 0,1 mol KI y = 0,033 mol NaClO
1 mol de NaClO è 74,5 g
0,033 mol de NaClO è z z = 2,48 g de NaClO
T = msoluto / msolução T = 2,48 / 50 T = 0,05 x 100% è 5%
RICARDO FELTRE – VOL 2 – SOLUÇÕES – Tira - Dúvidas - Aluna: EVELINE VALERIANO MOURA – Q 3 – 2000 – TURMA A1
09 – 140 g de iodo foi dissolvido em álcool, a seguir, juntou-se água até o volume de 250 mL. Dessa solução, retiraram-se 25 mL, que foram titulados com 5 mL de tiossulfato de sódio 0,2 normal. Qual a porcentagem de pureza do iodo analisado ?
Reação : I2 + 2 Na2S2O3 è 2 NaI + Na2S4O6
1 I2 + 2 Na2S2O3 è 2 NaI + Na2S4O6
Iodo tiosulfato de sódio
Cálculo do número de mols do iodo:
1,4 g è x
254 g è 1 mol x = 5,5 x 10 –3 mol de I2
5,5 x 10 –3 mol de I2 è 250 mL
z è 25 mL z = 5,5 x10-4 mol
Observe a dissociação do tiosulfato de sódio
Na2S4O6 è 2 Na+1 + 1 ( S406 ) –2
Normalidade = 0,2 N = x . M 0,2 = M x 2 M = 0,1
0,1 mol Na2S4O6 è 1 L
y è 5 x 10 –3 L y = 5 x 10-4 mol Na2S4O6
1 mol de I2 è 1 mol Na2S4O6
w è 5 x 10 –4 mol w = 5 x 10 –4 mol de I2
Inicialmente 5,5 x 10 –4 mol de I2 è 0,14 g de Iodo è 100%
Reagiu 5 x 10 –4 mol de I2 è 0,127 g de Iodo è x
X = 90,17 % grau de pureza
RICARDO FELTRE – VOL 2 – SOLUÇÕES – Tira - Dúvidas - Aluna: EVELINE VALERIANO MOURA – Q 3 – 2000 – TURMA A1
10 – A solubilidade do ar no sangue, a 1 atm e à temperatura de 37ºC, é de 6,6 x 10-4 mol/L. Suponha um mergulhador que respire ar comprimido a 10 atm. Suponha também que o volume de sangue circulante seja de 7 litros.
a-) Calcule o volume de ar total que sairá do organismo quando o indivíduo voltar à superfície, onde a pressão é de 1 atm?
b-) Qual o risco que o mergulhador corre se essa descompressão não se der num tempo adequado?
Volume molar ( 37º C , 1 atm ) = 25,4 L / mol.
RESOLUÇÃO PROPOSTA PELA ALUNA :
ALESSANDRA MENDONÇA MIRANDA – ALUNA DO CURSO Q 3 – TURMA A1 - 2000
R:
a-) P = 1 A
T = 37º c
6,6 X 10-4 mol
1 L
n 7 L
n = 4,62 x 10 –3 mols
P = 10 atm
nº mols = 10 x 4,62 x 10-3 mols = 46,2 x 10-3 mols
Ao voltar à superfície, o indivíduo libera:
n = 46,2 x 10-3 - 4,62 x 10-3 n = 4,158 x 10-2 mols
1 mol è 25,4 L
4,158 x 10-2 mols è volume V V = 105, 6 x 10-2 L
V = 1,056 L
Obs:
Aumento da pressão è
aumento da concentração dos reagentes
Pouco
mais de 1 litro de ar ( 1, 056 L )sairá do organismo na forma de bolhas
b-)
Uma subida rápida e descontrolada poderá causar uma embolia (obstrução dos
vasos sangüíneos), devido à grande quantidade de bolhas de ar que deixam o
organismo
11 - FESP-UPE – Dispõe – se de 20 litros de água oxigenada a 125 volumes. Para se preparar 100,0 litros de água oxigenada a 10 volumes, deve-se proceder praticamente da seguinte forma:
a- ) toma-se 10 litros de água oxigenada a 125 volumes e dilui-se a 100 litros
b- ) toma-se 100 litros de água oxigenada a 125 volumes e aquece-se até a proporção desejada
c- ) toma-se 8 litros de água oxigenada a 125 volumes e dilui-se a 100 litros
d- ) toma-se 80,0 litros de água oxigenada a 125 volumes e dilui-se a 100 litros
e- ) toma-se 125 litros de água oxigenada a 125 volumes e dilui-se a 100 litros
Dado: 1 litro de água oxigenada a 125 volumes libera 125 litros de oxigênio ( O2 ) nas CNTP
VERA NOVAIS – FÍSICO QUÍMICA – ATUAL EDITORA – SP – FRANCISCO BRUNO FERREIRA GUSMÃO - – ALUNO Q3 – 2000 – TURMA A2
R: Letra: C
R: Letra: C
Comentário:
Inicialmente temos 20 litros de H2O2 a 125 volumes, com esses dados é possível calcular a concentração de O2 que dispomos:
1 litro de H2O2 è 125 volumes è 125 litros de O2 ( g )
20 litros de H2O2 è 125 volumes è x litros de O2
x = 2 500 litros de O2
Observe que 125 volumes è 125 litros de O2
1 volume è z z = 1 litro de O2
O propósito desta questão foi alterado, observe:
Preparar 100 litros de água oxigenada a 10 volumes:
1 litro de H2O2 è 10 volumes è 10 litros
100 litros de H2O2 è 10 volumes è y y = 1 000 litros de O2
Devemos encontrar como alternativa correta, aquela alternativa que libera 1000 litros de O2
1 litro de H2O2 è 125 volumes è 125 litros O2
8 litros de H2O2 è 125 volumes è w w = 1000 litros de O2
12 - Uma solução 6,5 M de etanol em água tem massa específica 0,95 g / cm3. Calcule a molalidade e a fração molar de etanol dessa solução.
THIAGO MATOS – TURMA A1 – Q 3 – 2.000 – TIRA DÚVIDAS – Nº 6 - 2000
6, 5 M è 6,5 mols de etanol por 1 litro d = 0,95 g / cm3
d= m solução / V solução 0,95 g de etanol è 1 cm3
x è 1.000 cm3 x = 950 g de solução
1 mol etanol è 46 g
6,5 mols è y y = 299 g
m solução = m soluto + m solvente 950 g = 299 g + m solvente m solvente = 651 g ou 0,65 Kg
Cálculo da Molalidade:
6,5 mols de etanol è 0,65 Kg de água
z è 1 Kg de água z = 10 mols de etanol ou 10 Molal
Cálculo da fração molar:
Nsoluto = 6,5 mols e nsolvente = 0,651 Kg / 18= 651 / 18 = 36,16 nsolução = 42,66
6,5 mols è FM
42,66 mols è 1 FM = 0,15
13 - FESP – Misturam-se 20 mL de solução 1 M de HCl com 30 mL de outra solução 0,5 M de mesmo ácido . Coloca-se a mesma para reagir com 1,453 g de Na2CO3. Baseando-se nestas informações, indique a alternativa FALSA:
a- ) Há excesso de HCl
b- ) Há excesso de Na2CO3
c- ) Há formação de 1,604 g de NaCl
d- ) Há consumo de 1,001 g de HCl
e- ) Há produção de 0,014 mol de CO2
FRANCISCO BRUNO F. GUSMÃO – TURMA A2
– Q 3 – 2000 – LIVRO DE VERA NOVAIS – CAPÍTULO 7 TIRA DÚVIDAS – Nº
6 - 2000
M1 . V1 + M2 . V2 = MF . VF 1 M . 20 mL + 0,5 M . 30 mL = M F . 50 mL 20 + 15 = M F . 50
MF = 0,7 0,7 mol HCl è 1 L
X è 0,05 L x = 3,5 x 10 – 2 mol de HCl
2 HCl + 1 Na2CO3 è 2 NaCl + 1 H2O + 1 CO2
3,5 x 10 –2 1,75 x 10 –2
a proporção é:
106 g de Na2CO3 è 1 mol
1,453 g de Na2CO3 è y y = 1,3 x 10-2 mol de Na2CO3
2 HCl + 1 Na2CO3 è 2 NaCl + 1 H2O + 1 CO2
2,6 x10 –2 1,3 x 10-2 2,6 x10 –2 + 1,3 x 10-2 1,3 x 10-2
Há excesso de HCl pois temos 3,5 x 10 – 2 mol e só necessitamos 2,6 x10 –2 para reação.
14 - PUC – RJ – Adicionou-se 1,360 g de sulfato de cálcio a 200 mL de água obtendo – se a solução x . O sólido não dissolvido foi separado por filtração e, depois de seco, pesado. Qual a concentração de Ca++ wm x ? Quantas gramas de CaSO4 são recuperados, depois da filtração?
DADOS: solubilidade do CaSO4 = 5 x 10 –3 mols / litro - Peso Atômicos: Ca= 40,0 ; O = 16,0 e S = 32,0
a- ) 1 x 10 –2 M e 1,088 g
b- ) 5 x 10 –3 M e 1,360 g
c- ) 1 x 10 –2 M e 5 x 10 g
d- ) 1 x 10 –2 M e 0, 135 g
e- ) 1 x 10 –3 M e 1,224 g
PROPOSTA : GLÓRIA ELIZABETH DOS
SANTOS BRAGA – CURSO pH 2000 – RICARDO FELTRE – VOL2 – CAP 1 – Nº
25 -
Resolução proposta pelo PROF. PAULO
WENDEL
R:
Letra: E
R: Letra: E
200 mL e 1,360 g de CaSO4 1,360 g è x
136 g è 1 mol de CaSO4 x = 1 x 10 –2 mol
solubilidade 5 x 10 –3 mol è 1 Litro
y è 0,2 L y = 1 x 10 –3 mol
Temos: 10 x 10 - 3 mol
Solubiliza: 1 x 10 –3 mol
__________________________
Resta: 9 x 10 –3 mol resta de corpo de fundo
1 mol è 136 g de CaSO4
9 x 10 –3 mol è z z = 1,224 g de CaSO4
15 – CESCEM – SP – Ao se misturarem volumes iguais de soluções aquosas 5,0 x 10 –2 molar de KOH e de HNO3, a solução resultante será 2,5 x 10 –2 molar em relação aos íons:
a- ) H+ e K +
b- ) H+ e NO 3 -
c- ) K+ e NO 3 -
d- ) OH- e NO 3 -
e- ) OH- e H +
PROPOSTA
: LUDMILA MARTINS PACHECO - CURSO Q – 3 - 2000 – Resolução proposta pelo PROF.
PAULO WENDEL
R: Letra: C
1 mol KOH + 1 mol HNO3 è 1 KNO3 + 1 mol de H2O
5 x 10 –2 mol 5 x 10 –2 mol 5 x 10 –2 mol 5 x 10 –2 mol
por 1 L por 1 L por 2 L por 2 L
M = 5 x 10 –2 mol / 2 L M = 2,5 x 10 –2 mol / 1 L de KNO3 è K+ + NO3 –1
2,5 x 10 –2 mol / 1 L 2,5 x 10 –2 mol / 1 L
16 - ITA – SP – A análise de 100 mL de uma solução 0,010 molar de cloreto de titânio mostrou a existência de 0,048 g de íons titânio e íons cloreto suficientes para formar 0,430 g de cloreto de prata. A fórmula mínima do cloreto de titânio é :
a- ) TiCl
b- ) TiCl2
c- ) TiCl3
d- ) TiCl4
e- ) TiCl6
R: Letra:C
Ag + Cl è AgCl
108 g 35,5 g è 143,5 g
x è 0,430 g x = 0,106 g
Ti + Cl è TiCl
0,048 g 0,106 g è 0,154 g
0,154 g è 100%
0,106 g è y y = 68,83% è Cl = 68,83 %
0,154 g è 100%
0,048 g è z z = 31,16% è Ti = 31,16%
Cl = 68,83 % / 35,5 = 1,92 /0,64 = 3
Ti = 31,16 % / 48 = 0,64 / 0,64 = 1 TiCl3
PROPOSTA : LUDMILA MARTINS PACHECO - CURSO Q – 3 - 2000 – Resolução proposta pelo PROF. PAULO WENDEL
17 - ITA – SP – Sabe-se que 1,00 mol de uma substância dissolvida em 1,00 Kg de sulfeto de carbono produz uma elevação de 2,40 º C na temperatura de ebulição do mesmo. Verificou-se que 2,40 g de um elemento, dissolvido em 100 g daquele solvente, aumentaram sua temperatura de ebulição de 0,464 ºC. Sabendo-se que o peso atômico desse elemento é 31,0 , calcula-se que o número de átomos existentes na molécula do elemento dissolvido é:
a- ) 1
b- ) 2
c- ) 4
d- ) 6
e- ) 8
PROPOSTA
: VÍVIAN BOA VISTA RIZZUTO - CURSO Q – 3 - 2000 – RICARDO FELTRE – VOL2 – CAP 2
– Nº 22-
Resolução
proposta pelo PROF. PAULO WENDEL
R: Letra: C
DTE = KE . W 2,40 = KE x 1/1 KE = 2,40 ºC
DTE = KE . W 0,464 = 2,40 x 2,40 / PM x 0,1 PM = 124
31 . X = 124 X = 4
18 - ITA SP – O cilindro provido de um pistão móvel, esquematizado abaixo, contém apenas etanol puro e é mantido sob temperatura constante de 20º C. Assinale a alternativa que melhor representa a variação do volume ( V ) com a pressão ( P ) aplicada, abrangendo etanol desde completamente vaporizada até totalmente liquefeito.
<-------------
ETANOL PURO a 20ºC
ETANOL PURO a 20ºC

![]()

Pressão
![]()
PROPOSTA
: VÍVIAN BOA VISTA RIZZUTO - CURSO Q – 3 - 2000 – RICARDO FELTRE – VOL2 – 2 –
Nº 17-
Resolução
proposta pelo PROF. PAULO WENDEL
![]()
![]() V
V
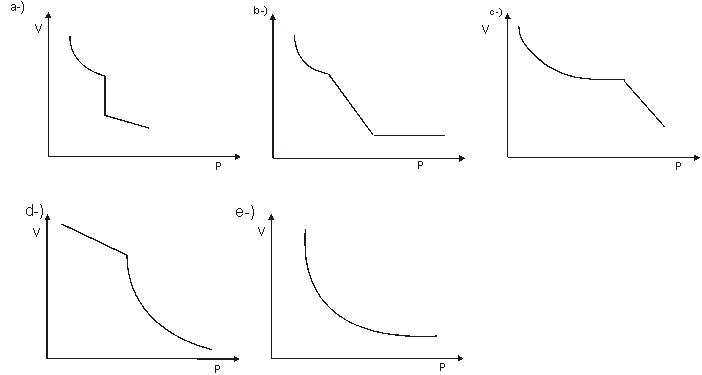
R: Letra: A
Note que trata-se de um gás que sofre uma transformação isotérmica, portanto pela Lei de Boyle – Mariotte, o gráfico será uma hipérbole eqüilátera, logo após, o etanol, sofre uma mudança de estado, de gás para líquido, a temperatura constante e a pressão constante, portanto haverá uma redução do volume e, o etanol já está liquefeito para sofrer um aumento de pressão e como está em estado líquido, haverá uma pequena redução do volume. Logo, o gráfico que melhor representa a transformação é o da letra A .
19 - Sabe-se que a solubilidade do CaCO3 em água a 25ºC é igual a 1 x 10-4 mol. Calcule a massa de carbonato de cálcio que pode dissolver em 10 L de uma solução 0,050 M de cloreto de cálcio?
DÚVIDA
DE ANA CAROLINA JALES – RICARDO FELTRE – FÍSICO – QUÍMICA
Resolução
Solubilidade: é a máxima quantidade de soluto que pode ser dissolvida em uma certa massa de solvente, a uma dada temperatura. Entretanto, no problema proposto veio especificado a temperatura da solução , a massa do soluto e não colocaram a massa de Solvente, ficando impossível resolver o problema proposto.
Raciocínio para resolução do problema: Devemos prestar atenção na quantidade cálcio dissolvido na solução , apesar dos dois sais propostos na questão serem solúveis (carbonato de cálcio e cloreto de cálcio) devemos nos preocupar com as proporções para não formamos corpo de fundo.
![]() Analisando a quantidade de Cloreto
de cálcio: equação :
CaCl2
Ca
⁺² + 2 Cl⁻
Analisando a quantidade de Cloreto
de cálcio: equação :
CaCl2
Ca
⁺² + 2 Cl⁻
![]() 0,050
mol
1L
0,050
mol
1L
![]() X
10 L
X = 0,5 mol de cloreto da cálcio
X
10 L
X = 0,5 mol de cloreto da cálcio
O cloreto de cálcio sofre dissociação produzindo 0,5 mol de Cátions Cálcio.
Ao analisar O Carbonato de Cálcio iríamos descobrir a quantidade de carbonato de cálcio que poderia ser dissolvido na solução, entretanto devemos desconsiderar o valor encontrado e diminuir da quantidade de cálcio já existente em solução , encontrando o valor real de carbonato de cálcio.
![]() CaCO3
Ca ⁺² + CO3 ⁻²
CaCO3
Ca ⁺² + CO3 ⁻²
![]() 1.10
mol de
CaCO3
V L de solução
1.10
mol de
CaCO3
V L de solução
![]() X
10 L de solução
X = n mols de CaCO3
X
10 L de solução
X = n mols de CaCO3
n mols de CaCO3 irá produzir n mols de cátions Cálcio.
Conclusão : A quantidade de Cálcio a ser adicionada na forma de carbonato da cálcio será (n mols – 0,5mol), encontrado a quantidade de cálcio a ser adicionada encontramos a quantidade de carbonato, obedecendo a estequiometria da equação.
20 - UFMG – 95 - O gráfico a seguir descreve a variação de temperatura observada quando Zn(s) é adicionado a volumes iguais de soluções de CuSO4( aq ) em diferentes concentrações. Essas espécies químicas reagem entre si originando íons Zn +2 (aq) como um dos produtos.
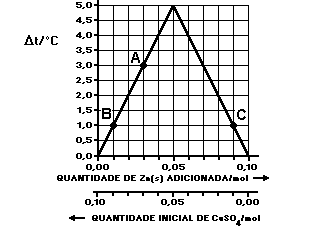
Considerando-se as informações fornecidas, a afirmativa FALSA é:
a) a proporção estequiométrica em que os reagentes se combinam é 1:1.
b) a reação é exotérmica.
c) a variação da temperatura indica a quantidade de íons Zn+2 ( aq ) formados.
d) o ponto A representa um sistema em que há excesso de CuSO4 ( aq ).
e) os pontos B e C representam sistemas contendo quantidades diferentes de íons Zn +2 ( aq ).
DÚVIDA
DE ANA CAROLINA JALES – RICARDO FELTRE – FÍSICO – QUÍMICA
Resolução:
A) Ao observarmos a equação, encontramos a proporção estequiométrica dos reagentes:
![]() Equação química : 1Zn +
1CuSO4
1 ZnSO4 + 1Cu
Equação química : 1Zn +
1CuSO4
1 ZnSO4 + 1Cu
Proporção 1:1
B) A reação de simples troca proposta é endotérmica, isto é, precisa absorve calor para ocorrer.
C) A variação de temperatura indica a quantidade de sulfato cúprico consumido (reagente) e a quantidade de zinco metálico formado( produto).
D) No inicio da reação tínhamos 0,1 mol de CuSO4 e zero mol de Zn metálico, ao tirarmos a leitura do ponto A , observamos O,03 mol de Zn metálico formado e um restante que não reagiu de CuSO4 ( 0,07 mol de excesso).
E) Os pontos B e C representam sistemas diferentes de zinco metálico. No ponto B a quantidade de zinco metálico é igual a 0,01 mol e no ponto C a quantidade de zinco metálico é igual a 0,09mol.
21 - 01 – FESP – PE - Uma solução contem 0,04 g/L de hidróxido de sódio totalmente dissociado. O volume de uma solução de ácido clorídrico 9,9 N que devemos adicionar à solução alcalina, para que o pH dessa solução se torne igual a 9 é:
a) 10 mL b) 1,0 mL c) 0,10 mL d) 0,01 mL e) 100 mL
ANDREZA MENDONÇA MIRANDA – RICARDO FELTRE – VOL. 2 – PÁG 297
- 147
Resolução
Para deixar a solução com alcalinidade mais baixa é necessária adicionar um ácido ou completar o volume com água.
No início: NaOH = 0,04 g/L = 0,001mol/L = 10 -³mol/L
NaOH Na + + OH -
10 -³ mol/L 10 -3 mol/L [OH-] = 10 -³ mol/L pOH = 3 pH = 11
Entretanto, a adição de ácido diminui o pH. O propósito da questão é diminuir o pH para 9.
pH = 9 pOH = 5 [OH -] = 9,9 . 10 -3 mol/L
[OH -] final = [OH -] tem - [OH-] reagiu com HCl
[OH -] final = 10 -³ mol/L - 9,9. 10-³ mol/L = 0,1. 10-³ mol/L = pOH = 4 pH = 10
· Cálculo do volume da solução ácida
9,9 Normal de HCl = 9,9 Molar de HCl 9,9 mol 1L
9,9. 10-³ mol X L X= 10-³L
pH =
10
1mL da solução de solução
pH = 9 Y Y = 0,1 mL de solução
22 - A solubilidade de um sal aumenta linearmente com a temperatura. Sabe-se que a 10ºC, 50g desse sal formam, com água, 300 g de solução saturada. Aquecendo essa solução a 50 ºC, a saturação só é mantida se acrescentados 100 g do sal. Calcular o coeficiente de solubilidade desse sal em água a 35º C.
TIRA – DÚVIDAS DE ÉDER GALIZA – GRAP – 2001
10o C Þ 50g do sal ¾ 250g de água
x ¾ 100g de água
x = 20g do sal
50o C Þ 150g do sal ¾ 250g de água
y ¾ 100g de água
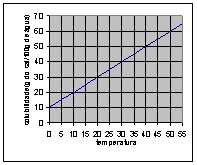
y = 60g do sal
35o C Þ 45g do sal/100g de água
23 - A análise de 3,9 g de uma amostra de sal de cozinha revelou 8,67 g de AgCl. Determine o teor de NaCl desse sal de cozinha.
TIRA – DÚVIDAS DE ÉDER GALIZA – GRAP – 2001
39 – 8,67 = 30,33g de NaCl
39 ¾ 100%
30,33 ¾ x
x = 30,33.100 = 77,77%
39
24 - 335-COVEST-2a FASE- 94 - Um mol de gás ideal nas CNTP ocupa 22,4 litros. Na composição do ar atmosférico, o oxigênio representa aproximadamente 20%. Quantos litros de ar são necessários para a queima completa de 0,25 mols de metano de acordo com a reação:
CH4(g) + 2O2(g) ® CO2(g) + 2H2O(g)
TIRA – DÚVIDAS –
SUÉLEN MARIA ARRUDA DE MEDEIROS – MASTER – 2001
1mol de CH4 è 2mol O2 0,5mol è 20% 1mol è 22,4L
0,5 mol de CH4è X Y è 100% 2,5mol è Z
X= 0,5 mol de O2 Y= 2,5 mol de ar Z= 56 L de ar
25 - COVEST-2a FASE-94- Uma amostra mineral forneceu para a idade da Terra o valor de 4,0 bilhões de anos. O elemento radioativo presente nesta amostra tem um tempo de meia vida de 800 milhões de anos e a fração do elemento ainda em atividade é 2n da quantidade original. Qual o valor de n (fórmula ln (co/c)=Kt, onde ln significa o logaritmo natural.)
TIRA – DÚVIDAS – FABIANA RIBEIRO DA SILVA BRAGA– MASTER –
2001
t= 4,0bilhões de anos
P= 800milhõe de anos
t= n x P
4 x 109 = n x 8 x 108
n=5
26 - UNICAP - PÉ - 94 - Q2 - Qual é, aproximadamente, o volume de ar, em metros cúbicos, nas CNTP, necessário para queimar completamente 648,5 mL de etanol (C2H6O). Dados detanol=0,8 g/mL e composição do
ar 20% de O2.
C2H6O + 3O2 ® 2CO2 + 3H2O
TIRA – DÚVIDAS – SUÉLEN MARIA
ARRUDA DE MEDEIROS – MASTER – 2001
d= m/v Þ 0,8 = m/648,5 Þ m = 518,8g n = m/MM = 518,8/46 = 11,28 mol
1mol de C2H6O è 3mol de O2 33,84è 20% 1mol è 22,4L
11,28mol de C2H6Oè X Y è 100% 169,2 mol è Z
X= 33,84 mol de O2 Y= 169,2mol de ar Z= 3790,08L 1m3 = 1000L Þ 3790,08L @ 4m3
27 - FESP- 1995 - Analise os dados abaixo referentes a uma série de três experiências realizadas envolvendo uma determinada reação. (Os dados constantes nesta tabela correspondem às quantidades estequiometricamente envolvidas na reação)
|
|
REAGENTES |
PRODUTOS |
||
|
|
A |
B |
C |
D |
|
1a experiência |
MA |
MB |
MC |
7,0 g |
|
2a experiência |
mA |
24,0 g |
15,0 g |
MD |
|
3a experiência |
20,0 g |
mB |
mC |
35,0g |
Na terceira experiência houve formação de 35,0 g de D. A massa de C obtida é:
a- ) 25,0 g
b- ) 3,0 g
c- ) 105,0 g
d- ) 75,0 g
e- ) 45,0 g
TIRA – DÚVIDAS – FABIANA RIBEIRO DA SILVA BRAGA– MASTER -
2001
R: Letra: A
Da lei de Lavoiseir podemos escrever:
mA + 24 = 15 + MD (1) e
20 + mB = mC + 35 (2)
Da lei de Proust podemos escrever:
mA = 24 =15 = MD (3)
20 mB mC 35
De (2) e (3)
20 + 24 mC = mC + 35 (x15)
15
300 + 24 mC = 15 mC +525
9 mC =225
mC =25g
28 - COVEST-2a FASE-96 - O ideal é que a pressão parcial do oxigênio no pulmão seja de 0,20 atm. Um mergulhador, que está sujeito a altas pressões, deve dosar o gás que respira para manter a pressão parcial do oxigênio nesse valor. Se ele estiver mergulhando a uma profundidade onde a pressão seja de 2,5 atm, qual deve ser a fração molar de oxigênio numa mistura oxigênio/nitrogênio para que ele possa respirar sem dificuldades? Assinale no cartão sua resposta multiplicada por 100.
TIRA – DÚVIDAS – SUÉLEN MARIA
ARRUDA DE MEDEIROS – MASTER – 2001
Po2 = Xo2 x Pt
0,20 = Xo2 x 2,5
Xo2= 0,20/2,5 = 0,08
0,08 x 100 = 08
29 - FESP – UPE – Um recipiente contém um gás a P= 1 atm ; V = 100L e T = 20º C. Em seguida sofre transformação isobárica., obtendo-se um estado intermediário. Este sofre transformação isotérmica, obtendo –se o estado fina com P2 = 2 atm ; .V2 = 53,4 L e T2 = 40ºC. As condições do estado intermediário são:
a) P’= 1 atm ; T’= 40ºC ; V’= 53.4 L d) P’= 2 atm ; T’= 30ºC ; V’= 80,5 L
b) P’= 2 atm ; T’= 20ºC ; V’= 100 L e) P’= 1 atm ; T’= 40ºC ; V’= 106,8 L
c) P’= 1 atm ; T’= 25ºC ; V’= 75,5 L
TIRA – DÚVIDA de MARCELO JARDSON
PEDRO DA SILVA – MASTER - 2001
Resolução:
P1 .V1 = Pi .Vi = P2 . V2
T1 T i T2
1atm .100L = Pi.Vi = 2 atm .53,4L
293 K T i 313 K
Do estado um para o estado intermediário a transformação é isobárica, portanto:
P1 = Pi = 1 atm.
Do estado intermediário para o estado dois a transformação é isotérmica, portanto:
Ti= Ti = 313 K = 40º C.
Para calcular o volume , temos:
V1 = V2 100 L = V2 V2 = 106,8 L
![]()
![]()
![]() T1
T2
293ºK 313ºK
T1
T2
293ºK 313ºK
Letra :E
30 - UF – VALE DO SAPUCAÍ – Um cientista queria obter 6 litros de oxigênio medidos a 27ºC e 0,82 atm de pressão e dispunha de nitrato de potássio que fornece oxigênio por decomposição térmica. A quantidade de nitrato de potássio que deveria ser usada para se obter o desejado, esta melhor representada pela opção:
a) 4,48 g d) 202 g
b) 40,4 g e) 95 g
c) 101 g
TIRA – DÚVIDA de FABRÍCIA SILVA –
GRAP – 2001
V = 6L
T = 27º C = 300ºK
P = 0,82 atm
R = 0,082 atm. L / mol. ºK
Reação química : KNO3 KNO2 + ½ O2
Cálculo do volume de gás oxigênio
PV = NRT 0,82 . 6 = n . 0,082 . 300 4,92 = n . 24,6
n = 0,2 , sabemos pela reação química que a quantidade de nitrato de potássio é o dobro da quantidade de oxigênio.
Números de mols do nitrato de potássio = 0,4
Massa de nitrato de potássio = 0,4 . 101 = 40,4 g
R: Letra: B
31 - Ricardo Feltre – Vol i – Pág – 343 – Questão 42 - Calcule em que temperatura (ºC), 3,69 x 10 20 moléculas de metano ( 1 mol = 16g ) exercem a pressão de 570 mmHg, quando ocupam o volume de 20,0 mL.
( Dados: R = 62,4 mmHg. L / mol . K ; N. Avogadro = 6,02 x 1023 )
TIRA – DÚVIDA de BRUNO FREIRE – GRAP
– 2001
T = ?
P = 570 mmHg
R = 62,4mmHg . L / mol. ºK
V= 20ml = 0,02L
P.V = n . R . T
1 mol 6,02.1023 moléc. 16g
3,69. 1020 moléc. m g m = 0,0098 / 16 g
P . V = n . R .T P . V = m/MM . R .T
570 . 20 .10-3 = 0,0098/16 . 62,4 . T 0,0382 . T = 11,4 T = 298ºK – 273 = T= 25ºC
32 – FEI ‑ SP - Uma solução 0,100 M de um monácido, de densidade 1,010 g/mL está 4,50% ionizada Calcule a temperatura de congelamento dessa solução. 0 peso molecular do ácido é igual a 300 (Constante crioscópica K c = 1,86 ºC).
TIRA DÚVIDAS DE ANA PAULA BERNADES – Turma Normal - 1999
Resolução:
M = nº de mols do soluto / volume da solução ( L ) 0,1 = n / 1 L n= 0,1 mol de soluto
nº de mols = massa ( g ) / PM 0,1 x 300 = m m = 30 g
d = msolução = msolução / Vsolução 1,010 x 1000 mL = msolução = 1.010 g
msolução - msoluto = msolvente 1010g – 30g = m solvente = 980 g = 0,98 Kg
W = nº de soluto / massa de solvente em Kg W = 0,1 mol / 0,98 = 0,102 molal
AcH ® Ac - + H+ q = 2 i = 1 + a . ( q – 1 ) i = 1 + 0,045 . ( 2-1 ) i = 1,045
Dtc = Kc . W. i Dtc = 1,86 . 0,102 . 1,045 = 0,198 ºC 0 ºC – tc = 0,198 tc = - 0,198 º